
高中化学课本中涉及化学生产知识的内容多种多样,如:合成氨工业,硫酸、硝酸的工业制法,硅酸盐工业,炼铁和炼钢等。化工生产知识是高中化学的重要内容之一,它集中体现了化学知识在工农业生产中的实践与应用,是理论联系实际的教学原则在课堂教学中得以贯彻的重要途径之一。化工生产知识除了化学内容外,还包括诸如化学反应原理、原料选择、能源消耗、设备结构、工艺流程、环境保护、新材料、卫生保健以及综合经济效益等诸多方面的热点前沿内容和问题。
学习和讨论化工生产中的这些问题,可以使学生了解化学原理在化学工业生产中的应用,使知识系统化、具体化,对于提高学生的综合素质,加强学生对不同学科之间的联系有着很重要的作用,对于巩固和加深所学的化学知识是十分重要的。同时还可以激发学生学习化学的兴趣和积极性,了解我国的一些化工生产状况,增强学生学好化学将来更好地建设祖国的责任感和事业心。下面就有关教材中化工生产的内容概括如下,期望能对大家的学习有帮助。

⒈ 接触法制硫酸
⑴ 化工生产原理:
六个原理:
① 增大接触面积,充分利用原料的原理(粉碎矿石);
② 增大反应物浓度原理(通入廉价的过量空气使较贵的SO2充分利用);
③ 热交换原理;(热交换器)
④ 逆流、浓H2SO4吸收原理;
⑤ 催化原理;
⑥ 循环连续生产,提高原料利用率的原理。
⑵ 主要原料:硫铁矿(FeS2)、空气、98.3%的浓H2SO4
⑶ 主要设备:沸腾炉、接触室、吸收塔
⑷ 生产阶段:
FeS2→SO2→SO3→H2SO4
三阶段:
① 二氧化硫的制取和净化;
主要反应:
4FeS2+11O2高温===2Fe2O3+8SO2(沸腾炉)
炉气三步净化:除尘、洗涤、干燥
除尘:除矿尘
洗涤:除砷、硒等的化合物
干燥:除水蒸气
② 二氧化硫接触氧化成三氧化硫;
主要反应:
2SO2+O2=2SO3(接触室)
③ 三氧化硫的吸收和硫酸的生成。
SO3+H2O==H2SO4(吸收塔内)

⑸ 提高原料利用率的方法
矿石粉碎得较小,跟空气接触面大、燃烧充分、烧得也快,提高了原料的利用率。
在接触室中,两次催化氧化。
在吸收塔中,利用逆向操作,增加吸收时间提高吸收效率。
二氧化硫的回收再利用。
⑹ 环境污染有关内容:
① 炉气中的杂质和危害:矿尘、砷、硒等的化合物可使催化剂中毒,水蒸气与SO2、SO3生成酸腐蚀设备,影响生产。二氧化硫和空气中的飘尘(作催化剂)接触或跟氮的氧化物接触,部分会被氧化成三氧化硫。硫的氧化物以及硫酸和硫酸盐随雨雪降到地面,这就是所谓的“酸雨”。
② 尾气的吸收:工业上通常是用氨水来吸收SO2:
SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3,
当吸收液中亚硫酸氢铵达到一定浓度后,再跟浓硫酸反应,放出二氧化硫气体,同时得到硫酸铵溶液:
2NH4HSO3+H2SO4=2SO2↑+2H2O+(NH4)2SO4,
(NH4)2SO3+H2SO4=SO2↑+H2O+(NH4)2SO4
放出的SO2可用于制液体二氧化硫作为化工原料,硫酸铵溶液经结晶、分离、干燥后制成固体硫酸铵肥料。
⑺ 注意事项:
经净化后的炉气通过热交换器预热后进入催化层,在催化剂表面发生接触性反应,故称接触法。该反应为放热反应。两种流体在热交换器中逆向流动通过管壁进行热量的传递,反应时生成的热传递给进入接触室的需要预热的混合气体,并冷却反应后生成的气体。
水或稀硫酸作吸收剂时,容易形成酸雾,吸收速度慢,吸收不充分不利于尽可能把三氧化硫吸收干净。故用浓硫酸(98.3%)来吸收SO3,吸收塔底放出的硫酸成分为 H2SO4·nSO3,吸收塔顶放出的气体主要成分为SO2、N2、O2。
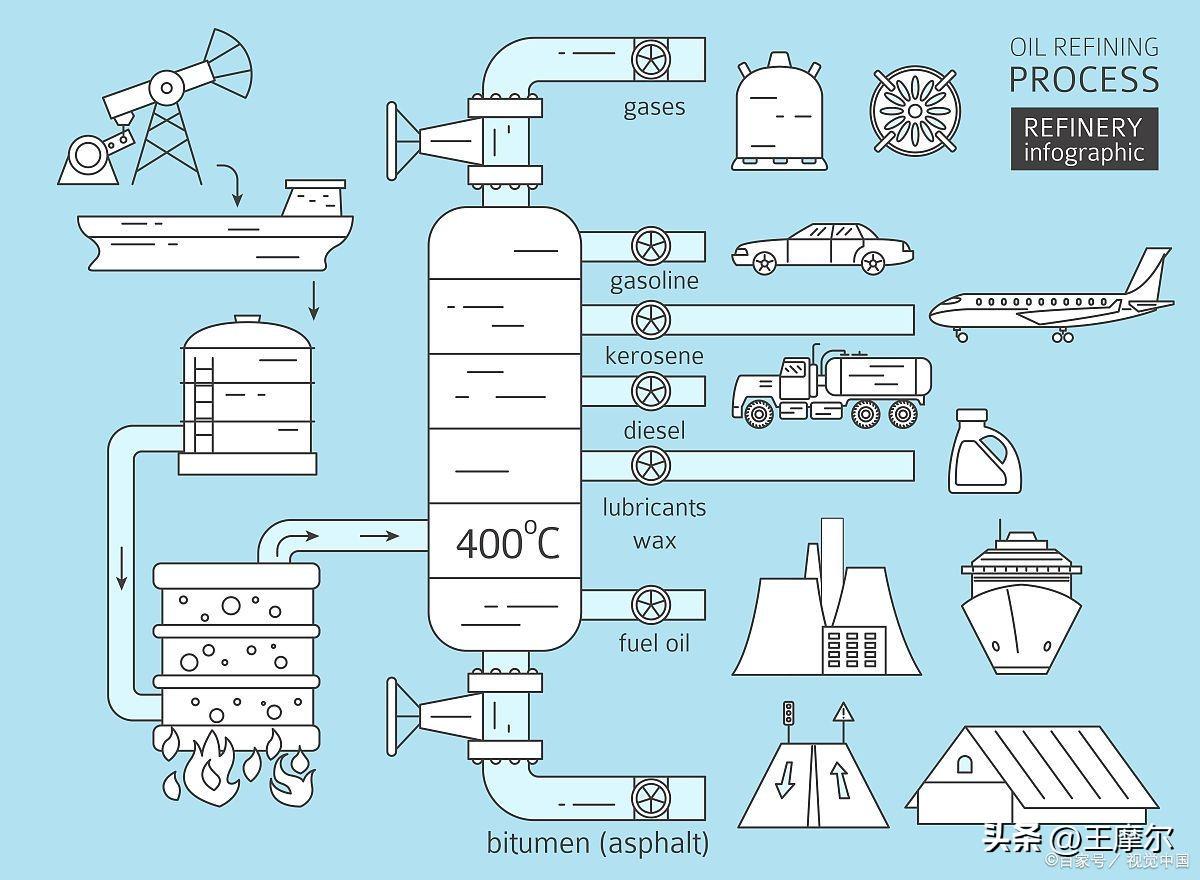
⒉ 硝酸的工业制法
以氨和空气为原料,用Pt—Rh合金网为催化剂在氧化炉中于800℃进行氧化反应,生成的NO在冷却时与O2生成NO2,NO2在吸收塔内用水吸收,在过量空气中O2的作用下转化为硝酸,最高浓度可达50%。
⑴ 化工生产原理:
① 反应物的循环操作
② 增大反应物的浓度
③ 逆流。
⑵ 主要原料:氨、水、空气
⑶ 主要设备:氧化炉、吸收塔
氧化炉:氨氧化成一氧化氮;
吸收塔:一氧化氮转化成二氧化氮,用水吸收二氧化氮生成硝酸。
⑷ 生产阶段:
① 氨的催化氧化
4NH3+5O2==(催化剂、高温)4NO+6H2O(放热反应)
② 硝酸的生成
2NO+O2==2NO2(放热反应)
3NO2+H2O==2HNO3+NO(放热反应)
4NO2+O2+2H2O==4HNO3
反应中的NO可以进入循环利用,制取得50%的硝酸。
蒸馏浓缩:用浓硫酸或硝酸镁作吸水剂进行蒸馏浓缩可得到更浓的硝酸。这种方法可制得96%以上的硝酸溶液,甚至98%以上的“发烟”硝酸。
⑸ 环境污染有关内容:产生的NO、NO2造成污染,用碱液吸收
① 尾气:NO、NO2、N2等
② 尾气吸收措施:
生产过程中NO循环使用,可以最大程度利用原料,并且减少尾气中的NOx的排放。尾气一般用NaOH溶液进行吸收,发生氧化还原反应,可以综合利用尾气中的NOx
2NO2+2NaOH =NaNO2+NaNO3+H2O
2NaOH+NO+NO2=NaNO3+H2O
⑹ 注意事项
① 增大反应物的浓度
② 选择适当的温度
③ 使用催化剂
④ 增大反应物的接触面
⑤ 反应物循环使用
⑥ 利用化学反应放出的热

⒊ 炼铁
⑴ 反应原理:
利用氧化还原反应,在高温下,用还原剂(主要是CO)把铁从铁矿石里还原出来。
⑵ 主要原料:铁矿石、焦炭、石灰石和空气
⑶ 主要设备:高炉
⑷ 生产过程
①还原剂的生成
C+O2=点燃=CO2
CO2+C=Δ=2CO
②铁矿石还原成铁
Fe2O3+3CO===(高温)2Fe+3CO2
Fe3O4+4CO==(高温)3Fe+4CO2
③除脉石、炉渣的形成
CaCO3==(高温)CaO+CO2↑
SiO2+CaO==(高温)CaSiO3
⑸ 环境污染有关内容:产生CO、CO2和N2等混和气(叫“高炉煤气”)造成污染。

⒋ 炼钢
⑴ 反应原理:
利用氧化还原反应,在高温下,用氧化剂把生铁中过多的碳和其它杂质氧化为气体或炉渣除去。
⑵ 主要原料:炼钢生铁、生石灰、氧气、氧化剂(空气、纯氧或氧化铁)
⑶ 主要设备:氧气顶吹转炉、电炉
⑷ 炼钢时的主要反应:
① 氧化剂的生成,热能的来源
2Fe+O2===(高温)2FeO
② 降碳:降低碳的含量
C+FeO===(高温)Fe+CO
③ 除硫、磷:除去S、P等杂质
④ 脱氧:加硅铁、锰铁、铝除剩余FeO
Si+2FeO===(高温)2Fe+SiO2
⑸ 环境污染有关内容:产生大量棕色烟气造成污染,成分:Fe2O3尘粒和高浓度CO。

⒌ 合成氨工业
⑴ 主要原料:燃料(煤、天然气、石油),空气,水
⑵ 主要设备:合成塔氨、分离器
⑶ 生产阶段:
① 原料气N2、H2)的制备
C+H2O(气)=(高温)CO+H2
CO+H2O=(可逆 催化剂)CO2+H2
② 净化和压缩
③ 氨的合成
N2+3H2⇌(催化剂、高温高压)2NH3
④ 氨的分离
⑷ 反应特点:
① 可逆反应;
② 正反应是放热反应;
③ 正反应是气体体积减小的反应。

⒍ 侯氏制碱(纯碱)
⑴ 反应原理:
侯氏制碱法是依据离子反应发生的原理进行的,离子反应会向着离子浓度减小的方向进行(实质为勒夏特列原理).制备纯碱(Na2CO3),主要利用NaHCO3在溶液中溶解度较小,所以先制得NaHCO3,再利用碳酸氢钠不稳定性分解得到纯碱。要制得碳酸氢钠就要有大量钠离子和碳酸氢根离子,所以就在饱和食盐水中通入氨气,形成饱和氨盐水,再向其中通入二氧化碳,在溶液中就有了大量的钠离子、铵根离子、氯离子和碳酸氢根离子,其中NaHCO3溶解度最小,所以先析出,其余产品处理后可作肥料或循环使用。
⑵ 主要原料:
食盐水、氨气和二氧化碳(合成氨厂用水煤气制取氢气时的废气)。
⑶ 生产阶段:
① 先向水中通入氨气,然后再通入二氧化碳
NH3+H2O+CO2=NH4HCO3
② NaHCO3溶解度最小,所以析出。
NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③ NaHCO3热稳定性很差,受热容易分解
2NaHCO3=△=Na2CO3+CO2↑+H2O
且利用NH4Cl的溶解度,可以在低温状态下向②的溶液中加入NaCl,则NH4Cl析出,得到化肥,提高了NaCl的利用率。

⒎ 氯碱工业
⑴ 主要原料:食盐水
⑵ 主要设备:立式隔膜式电解槽
⑶ 生产阶段:食盐水净化、电解食盐水、NaOH的分离
⑷ 反应方程式:
2NaCl+2H2O=2NaOH+Cl2↑+H2↑
⑸ 尾气的吸收:
① 含氯废气制次氯酸盐:该法采用填料塔或喷淋塔等废气处理塔,以碱液吸收处理废气。常用的碱液为NaOH、Ca(OH)2和Na2CO3。所排出的吸收液为次氯酸盐产品。
② 氯废气制水合肼:该法是以碱液作为吸收剂处理废气中的氯,最后制成水合肼。含氯废气除尘和降温后,进入吸收塔与30%的NaOH溶液反应生成次氯酸钠。其反应原理是:
2NaOH+Cl2→NaCl+NaOCl+H2O
NaOCl+NH2CONH2+2NaOH→N2H4·H2O+NaCl+Na2CO3
处理后,尾气中的氯含量可达0.05%以下。
③ 水吸收法:当废气中氯的浓度小于1%时,用水吸收氯废气,然后再用水蒸气加热解吸,回收氯废气。
⑹ 注意事项:
① 盐水要饱和;
② 正电极不能用金属材料;
③ 正负极要隔离

⒏ 制玻璃
⑴ 主要原料:石灰石、纯碱和石英
⑵ 主要设备:玻璃熔炉
⑶ 反应方程式:
Na2CO3+SiO2===(高温)Na2SiO3+CO2
CaCO3+SiO2===(高温)CaSiO3+CO2
⑷ 成分:Na2SiO3;CaSiO3;SiO2

⒐ 制水泥
⑴ 主要原料:石灰石和粘土
⑵ 主要设备:水泥回转窑
⑶ 反应方程式:是化学变化,方程式不掌握
⑷ 成分:2CaO·SiO2;3CaO·SiO2;3CaO·Al2O3

⒑ 工业制硅
⑴ 反应原理:
工业上,通常是在电炉中由碳还原二氧化硅而制得。
⑵ 主要原料:
石英砂(SiO2)和C
⑶ 主要设备:
矿热炉(其中一个装置就是电炉)
⑷ 生产阶段:
① 二氧化硅和炭粉在高温条件下反应,生成粗硅:
SiO2+2C==(高温)Si(粗)+2CO↑
② 粗硅和氯气在高温条件下反应生成氯化硅:
Si(粗)+2Cl2==(高温)SiCl4
③ 氯化硅和氢气在高温条件下反应得到纯净硅:
SiCl4+2H2==(高温)Si(纯)+4HCl

⒒ 工业制盐酸
工业上制取盐酸时,首先在反应器中将氢气点燃,然后通入氯气进行反应,制得氯化氢
气体。
H2+Cl2=(点燃)2HCl;
氯化氢气体冷却后被水吸收成为盐酸。
在氯气和氢气的反应过程中,有毒的氯气被过量的氢气所包围,使氯气得到充分反应,
防止了对空气的污染。在生产上,往往采取使另一种原料过量的方法使有害的、价格较昂贵的原料充分反应。

⒓ 工业制乙烯
⑴ 由石油分离生产:乙烯是由石油化工裂解而成。在这个过程中,气态或轻液态烃被加热到750-950℃ ,诱使许多自由基反应,然后立即淬火冻结反应。这个过程中,把大分子碳氢化合物转换到较小分子的碳氢化合物,并反应出不饱和烃。
⑵ 由煤合成法:煤基制烯烃技术,它是C1化工新工艺, 是指以煤气化的合成气合成的甲醇为原料,借助类似催化裂化装置的流化床反应形式,生产低碳烯烃的化工技术。C2H5O===(170摄氏度,浓硫酸)C2H4+H2O
⒔ 工业制乙炔
乙炔的工业制法主要以碳化钙水合、甲烷部分氧化裂解和烃裂解法制备:
⑴ 碳化钙法:焦碳和氧化钙在2200℃制得碳化钙,再水解得乙炔。
CaC2+2H2O===Ca(OH)2+C2H2
⑵ 天然气制乙炔法:甲烷在1500℃的高温下隔绝空气部分氧化或受热分解,得到C2H2。
2CH4==(高温催化剂)C2H2+3H2
⑶ 烃类裂解:用重质油或原油裂解,得乙炔的同时副产乙烯,典型的裂解气组成为乙炔8.65%,乙烯0.5%,其余为H2和CO。

⒕ 制取CO2
⑴ 煅烧法:高温煅烧石灰石(或白云石)过程中产生的二氧化碳气,经水洗、除杂、
压缩制得气体二氧化碳:
CaCO3=高温=CaO+CO2↑;
⑵ 发酵气回收法:生产乙醇发酵过程中产生的二氧化碳气体,经水洗、除杂、压缩,制得二氧化碳气。
⑶ 副产气体回收法:氨、氢气、合成氨生产过程中往往有脱碳(即脱除气体混合物中二氧化碳)过程,使混合气体中二氧化碳经加压吸收、减压加热解吸可获得高纯度的二氧化碳气。
⑷ 炭窑法:由炭窑窑气和甲醇裂解所得气体精制而得二氧化碳。

⒖ 水煤气的工业制法
水煤气是水通过灼热的碳层而生成的气体,主要成份是一氧化碳、氢气、燃烧后排放水和二氧化碳,有微量CO、HC和NOx。在气化炉中,碳与蒸汽主要发生如下的水煤气反应:
C+H2O===(高温)CO+H2(生成水煤气)
C+2H2O===(高温)CO2+2H2
学习时还应注意:
1.炼铁、制玻璃和制水泥三工业都要用到石灰石;
2.接触法制硫酸和硝酸的工业制法共同用到的设备是吸收塔;
3.接触法制硫酸、硝酸的工业制法、炼铁(炼钢)都需要鼓入过量空气;
4.炼铁和炼钢的尾气中均含有可燃性气体CO。

相关文章

我没爹没娘,是个乞丐。自打我有记忆起,我就流落在京城街头巷尾的最肮脏的角落。阴暗的、潮湿的、老鼠横行的垃圾堆就是我觅食的地方。冷硬的、发霉的,长满青苔的墙角就是我歇脚
2025-09-16 15:13:04
第一章:血色嫁衣猩红的血,浸透了苏晚卿身上的嫁衣。她跪在冰冷的宫殿地砖上,看着眼前相拥的两人——她的夫君,大胤王朝的皇帝萧玄,和她的庶妹苏怜月。苏怜月依偎在萧玄怀里,手中还
2025-09-16 14:51:00
痛!四肢传来撕裂般的酸疼,沈茉皱起眉头。昏迷前的那一幕幕划过她的脑海。鲜血从手腕喷涌而出、野狗的撕扯、还有令人发指的笑……眼前的脸正越靠越近,沈茉几乎本能地抬起手,“啪
2025-09-16 12:00:03
我爸将发给助理的消息错发给了我。“宝贝,刚给你买的跑车就停在车库,车钥匙在你最喜欢的那个铂金包里。”我面无表情地看完,回了条消息。“城东那套别墅,明天之内,转到我名下。”
2025-09-15 16:44:05
路索保险柜:为您打造安全与便捷的储物空间路索保险柜,为您的爱物保驾护航。作为一家全国知名的保险柜生产,驰球始终致力于为客户提供专业、贴心的储物解决方案。无论是家庭、办公室还是企业,路索保险柜都能满足您的需求,为您提供安全、可靠的储物空间。安全性能卓越,给您无后顾之忧 路索保险柜采用先进
2025-09-15 16:39:47热门文章