一、粗盐提纯
海水中溶解有大量的食盐,通过蒸发浓缩海水,可以得到大量的粗盐,粗盐中食盐约占80%,还含有其他难溶性杂质(泥沙),以及一些可溶性盐(MgCl2、MgSO4、CaSO4等),泥沙可以通过过滤除去(初中),而可溶性盐一般采用沉淀法除去。
杂质离子 | 除杂离子 | 除杂试剂 | 离子反应 |
Mg2+ | OH- | NaOH | Mg2+ + 2OH- = Mg(OH)2↓ |
Ca2+ | CO32- | Na2CO3 | Ca2+ + CO32- = CaCO3↓ |
SO42- | Ba2+ | BaCl2 | Ba2+ + SO42- = BaSO4↓ |
引入的杂质离子 | / | / | / |
Ba2+ | CO32- | Na2CO3 | Ba2+ + CO32- = BaCO3↓ |
OH- | H+ | HCl | OH- + H+ = H2O |
CO32- | H+ | HCl | CO32- + 2H+ = H2O + CO2↑ |
【注意】
a、由上表可知,除杂使用的试剂为NaOH、Na2CO3、BaCl2、HCl;
b、实际操作时候,为了保证杂质完全被除去,因此所加入的除杂试剂是稍过量的,因此,还需要将稍过量的除杂试剂除去;
c、四种试剂的添加顺序不固定,只需满足Na2CO3在BaCl2后面加(Na2CO3的作用是除去Ca2+和加入的Ba2+),以及盐酸最后添加(先过滤再加入盐酸,防止沉淀被盐酸溶解);
d、最后过量的盐酸可以通过加热的方法除去。
二、氯碱工业
粗盐提纯得到纯度较高的氯化钠,是一种重要的化工原料,通过电解饱和食盐水得到氯气、氢气和烧碱,并以它们为原料生产一系列含氯、含钠的化工产品的工业称为氯碱工业。
(1)反应方程式:
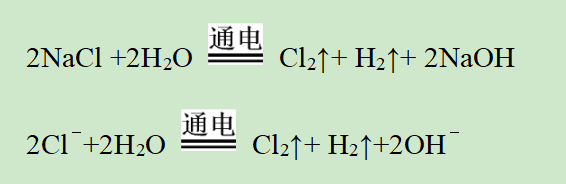
(2)实验装置:
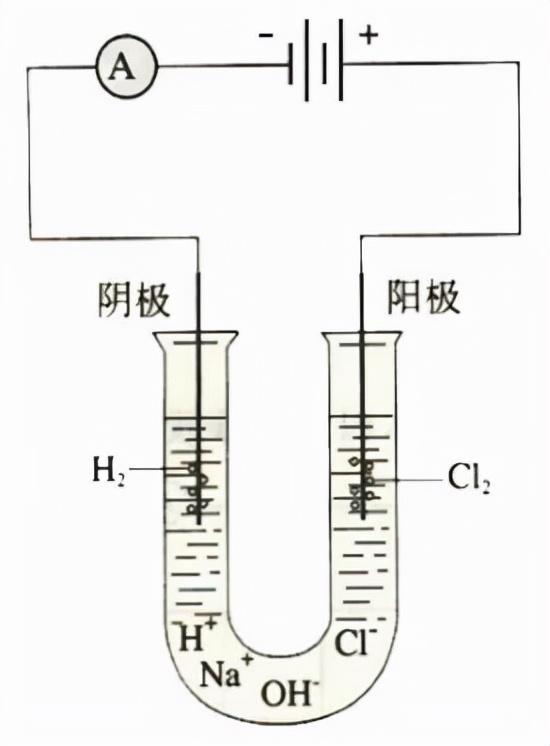
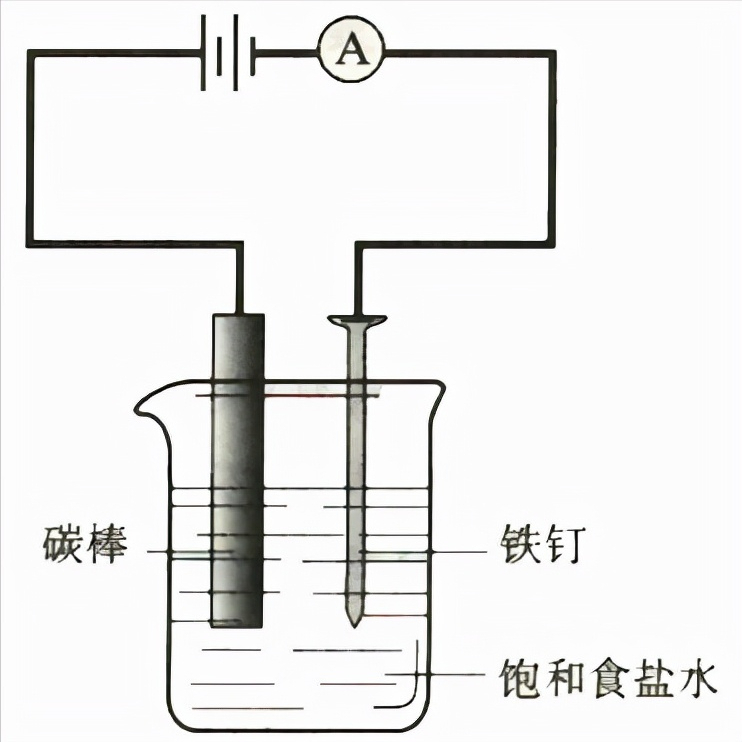
【注意】阴阳极和正负极
a、阴极:得到电子的电极,在电解反应中为和电源负极相连的电极;阳极:失去电子的电极,在电解反应中为和电源正极相连的电极。
b、正极:电源中电子流入(得电子)/电流流出,电势较高的电极;负极:电源中电子流出(失电子)/电流流入,电势较低的电极;
c、正极≠阳极;负极≠阴极,电源才有正负极,实际发生反应产生现象的是在阴阳极。
(3)电极反应和实验现象:
电极反应是指在电极上发生的得到或者失去电子的反应,通常用电极反应式表示,阳极失去电子发生氧化反应,阴极得到电子发生还原反应。
阳极:2Cl- - 2e- = Cl2↑ (氧化反应)
阴极:2H2O + 2e- = H2↑ + 2OH- (还原反应)
根据阴阳极的电极反应即可写出相应的反应现象:
阳极:产生黄绿色气体,该气体能够使得淀粉碘化钾溶液变蓝色;
阴极:产生无色无味气体,(若点燃该气体,产生淡蓝色火焰),阴极处溶液变红(若滴加酚酞溶液)
(4)该反应的应用:工业制备氯气、氢气和烧碱
(5)该反应的改进:离子交换膜法电解饱和食盐水,原理如下

【注意】
a、水箱中用一层阳离子交换膜隔开,只允许阳离子(Na+)通过;
b、右下水中含有少量NaOH的作用是增强溶液的导电性;
【优势】通过阳离子交换膜,使得氯气和氢气在不同的出口生成,从而
a、安全,避免氯气和氢气混合之后见光爆炸;
b、纯净,避免氯气和NaOH接触反应,从而得到较纯的NaOH。
(6)氯碱工业的后续反应:
氢氧化钠 | 造纸、玻璃、肥皂、纺织印染 |
含氯漂白剂(84等) | |
氯气 | |
有机合成、氯化物合成、农药 | |
盐酸工业 | |
氢气 | |
有机合成、金属冶炼 |
相关文章

真心太阳能售后服务电话400-883-2086越来越多的人意识到家财安全的重要性,为了保护贵重物品的安全,真心太阳能成为了很多家庭的必备品。而真心太阳能作为国内知名品牌,其专业服务备受广大消费者的赞誉。真心太阳能专业服务电话(以产品说明书或保修卡电话为准),全方位解决您的家财安全问题。专
2025-04-20 15:42:32
家得适指纹锁全国统一售后服务热线电话24小时 400-883-2086家得适指纹锁作为一家知名的品牌,一直致力于为用户提供优质的产品和完善的售后服务。为了更好地为广大用户解决产品使用过程中的问题和困扰,我们特别设立了全国统一服务热线电话,并且24小时为您提供故障报修服务
2025-04-20 15:41:11
戴纳斯帝壁挂炉客服电话为:400-883-2086 戴纳斯帝壁挂炉作为国内知名门锁品牌之一,一直以来都致力于为消费者提供高品质的产品和优质的服务。作为戴纳斯帝壁挂炉的核心部分,门锁客服团队是一个不可或缺的存在。无论您是在购买前需要咨询产品信息,还是在使用过程中需要解决问题,戴纳斯帝壁挂炉客
2025-04-20 15:39:53
经纬保险柜作为家用设备的领先品牌,始终致力于为用户提供高品质的产品和专业的售后服务。无论您遇到任何问题,都可以拨打经纬保险柜售后服务电话:400-883-2086,我们的专业团队将为您提供及时、高效的解决方案。经纬保险柜全国各市24小时售后服务点热线号码实时反馈-今-日-更-新日常使用故障及
2025-04-20 15:39:26
BEKO燃气灶在市场上受到了广泛用户的喜爱和信任,尤其是其全国24小时客服热线,为用户提供了一个方便快捷的服务渠道。近期有许多用户向我们反映了一个共同的问题——BEKO燃气灶是否频繁出现故障的现象?针对这一疑问,我们将从以下几个方面为您解答:BEKO燃气灶售后服务电话:(400-883-20
2025-04-20 15:36:35热门文章